Опишите явление полиморфизма в приложении к железу какое практическое значение оно имеет
Обновлено: 19.09.2024
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или, как их называют, в разных полиморфных модификациях. В результате полиморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа. Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой , при более высокой , затем и т. д.
Полиморфное превращение протекает в том случае, если при данной температуре может существовать металл с иной кристаллической решеткой и меньшим запасом свободной энергии.
Переход чистого металла из одной полиморфной модификации в другую в условиях равновесия протекает при постоянной температуре (критическая точка) и сопровождается выделением теплоты, если превращение идет при охлаждении, или поглощением теплоты - в случае нагрева.
Как и при кристаллизации из жидкой фазы, для того чтобы полиморфное превращение протекало, нужно некоторое переохлаждение (или перенагрев) относительно равновесной температуры, для возникновения разности свободных энергий между исходной и образующейся новой модификациями. В твердом металле в отличие от жидкого возможно достижение очень больших степеней переохлаждения. Полиморфное превращение по своему механизму - кристаллизационный процесс осуществляется путем образования зародышей и последующего их роста.
В результате полиморфною превращения образуются новые кристаллические зерна, имеющие другой размер и форму, поэтому такое превращение также называют перекристаллизацией. Полиморфные превращения происходят не только в чистых металлах, но и в сплавах. Полиморфное превращение сопровождается скачкообразным изменением всех свойств металлов или сплавов: удельного объема, теплоемкости, теплопроводности, электропроводности, магнитных свойств, механических й химических свойств и т. д.
График кристаллизации Fe

Рис. 1 Схема зависимости величины свободной энергии от температуры для Fe и Fe.
Полиморфизм для железа. Из рисунка видно, что в интервале температур 910 – 1392 °С устойчивым является - железо с кристаллической решеткой, имеющей меньшую свободную энергию, чем -железо, а при температурах ниже 910°С и выше 1392 °С устойчиво -железо, так как его свободная энергия меньше, чем -железа.
2. Вычертите диаграмму состояния сурьма-германий. Опишите взаимодействие компонентов в жидком и твердом состояниях. Укажите структурные составляющие во всех областях диаграммы состояния и объясните характер изменения свойств сплавов в данной системе с помощью правила Курнакова.
Заполнить диаграмму

Рис. 2 Диаграмма состояния сплавов Sb – Ge
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (III рода)
Диаграмма с эвтектическим превращением
Исходные данные: оба компонента (Sb и Ge) неограниченно растворимы в жидком состоянии, ограниченно растворимы в твердом состоянии и не образуют химических соединений.
Компоненты: химические элементы А - Sb, В - Ge (К = 2).
Фазы: жидкость Ж, твердые растворы (раствор Sb в Ge) и (раствор компонента Ge в Sb) (Ф = 3).
В этой системе не образуются фазы, представляющие чистые компоненты. Из жидкости выделяются только ?, ?. Около вертикалей А, В, соответствующих чистым компонентам, находятся области существования твердых растворов ?, ?.
Предельная растворимость ?-раствора линия DF. Эти линии называются сольвус.
Точка Е является результатом пересечения двух линий ликвидус АЕ, ВЕ, поэтому в т. Е жидкость насыщена фазами ?, ?. При малейшем переохлаждении жидкость становится пересыщеной ? и ? и начинает их выделять.
Точка Е – эвтектика, сплав – эвтектический, линия DEC – эвтектическая линия, процесс кристаллизации – эвтектический, структура – эвтектическая.
Рассмотрим кристаллизацию сплава I, которая начинается в точке 1, заканчивается затвердевание в точке 2. От точки 2 до точки 3 изменений в структуре нет. В точке 3 начинается вторичная кристаллизация ? II , это продолжается до комнатной температуры.
Вторичными кристаллами называется фаза II , которая выделяется из пересыщенного раствора , состав которого изменяется по линии CG. При понижении температуры количество II возрастает. Процесс выделения вторичных кристаллов называется вторичной кристаллизацией. Сплав II называется заэвтектическим.
Сплавы, которые располагаются леве эвтектической точки Е в интервале концентраций ЕС, называются доэвтектическими. Они кристаллизуются в два этапа. На первом этапе из жидкой фазы выделяются кристаллы , на втором этапе на линии DEC остаток жидкости распадается по эвтектической схеме L ? ? + ?. Конечная структура + эвт. (? + ?).
Как показал Н.С. Курнаков, между составом и структурой сплава, определяемой диаграммой состояния и свойствами сплава, существует определенная зависимость (рис.3).

Рис. 3 Связь между диаграммой состояния (структурой) и свойствами сплавов.
В сплавах с ограниченной растворимостью свойства при концентрациях, отвечающих однофазному твердому раствору, изменяются по криволинейной зависимости (рис. 3). В области механической смеси свойства изменяются по прямой, т.е. представляют собой среднее из свойств фаз, образующих смесь. Так, если одна фаза мягкая и пластичная, а другая твердая и хрупкая, то сплав тем тверже и хрупче, чем больше в нем второй фазы.
4. Вычертите диаграмму состояния железо-карбид железа. Укажите структурные составляющие во всех областях диаграммы, опишите превращения и постройте кривую нагревания в интервале температур от 0 до 1600°С (с применением правила фаз) для сплава, содержащего 1, 2% С. Для заданного сплава при температуре 1250°С определите: состав фаз, т. е. процентное содержание компонентов в фазах; количественное соотношение фаз. Нет ответа

Рис. 5 Диаграмма состояния сплавов Fe – Fe3C.
Диаграмма состояния системы Fe- Fe3C. Компонентами системы являются:
• железо; температура плавления 1539 °С (точка А диаграммы), температура полиморфного превращения 911 °С (точка G);
• цементит; температура плавления 1560°С (точка D диаграммы).
Цементит - химическое соединение железа с углеродом. Стсхиомстрнчсская формула цементита – Fe3C (карбид железа), и он содержит 6,67% С. Цементит имеет сложную ромбическую кристаллическую решетку, расплавляется при температуре 1600 °С, обладает высокой твердостью (НВ 800) и большой хрупкостью. По условиям образования различают: первичный Ц1 (образуется при кристаллизации из жидкости в виде больших светлых кристаллов), вторичный Ц2 (выделяется из аустснита в виде сетки по границам зерен), третичный Ц3 (выделяется из графита в виде мелких зерен).
Помимо химического соединения цементита (Ц) железо образует с углеродом твердые растворы и смеси, которые являются фазовыми и структурными составляющими.
Твердые растворы.
Феррит (Ф) - твердый раствор углерода в -железе, обозначается Fe (C). Растворимость углерода в феррите весьма низкая - около 0,006 % при 20 °С (точка Q диаграммы), она возрастает при повышении температуры и достигает максимального значения 0,02% при 727 °С (точка Р диаграммы). Кристаллическая решетка феррита - ОЦК. Феррит - твердый раствор внедрения: атомы углерода располагаются в междоузлиях решетки -железа. Феррит магнитен и весьма пластичен. Твердость феррита 80. 100 НВ.
Аустенит (А) - твердый раствор углерода в -железе. обозначается Fe(C). Аустенит существует только при высоких температурах - 727 °С и выше. Растворимость углерода в аустените высокая - 0,8% при минимальной температуре его существования 727 °С (точка 5 диаграммы). Она возрастает при повышении температуры (так же, как в феррите) и достигает максимального значения 2,14% при температуре 1147°С (точка Е диаграммы). Кристаллическая решетка аустенита - ГЦК. Аустенит - твердый раствор внедрения. Аустенит немагнитен, его удельный объем меньше, чем у феррита, вследствие более высокой атомной плотности. Твердость аустенита около 200 НВ.
Цементит, феррит и аустенит являются однофазными структурными составляющими.
При температуре 1 147 °С в сплавах с содержанием углерода 2,14% и более из жидкого состояния образуется эвтектика. Эвтектическое превращение происходит при постоянной температуре. При эвтектическом превращении одновременно существуют три фазы: жидкая и две твердые.
Эвтектика в системе Fe- Fe3C называется ледебуритом (Л), который представляет собой смесь аустенита и цементита. Ледебурит образуется при кристаллизации жидкости постоянного состава (4,3 % С). Эвтектическое превращение с образованием ледебурита можно записать формулой . Цифры означают содержание углерода в соответствующих фазах в момент превращения: его содержание в аустените, равное 2,14%, соответствует точке F диаграммы; содержание углерода в цементите 6,67 % -точке F. Конода при температуре 1 147 °С совпадает с линией диаграммы ECF. Ледебурит имеет высокую твердость (550 HV), очень хрупок.
При температуре 727 °С в сплавах с содержанием углерода 0,02 % и более аустенит превращается в смесь феррита и цементита, причем эти фазы выделяются одновременно. Таким образом, в превращении одновременно участвуют три фазы, т.е. оно происходит при постоянной температуре. Такое превращение из твердого раствора получило название эвтектоидного в отличие от эвтектического, где исходная фаза - жидкость. Полученная смесь в общем случае называется эвтектоид.
В системе Fe- Fe3C эвтектоид называется перлитом (П). Процесс превращения аустенита в перлит можно записать формулой: . Содержание углерода в феррите соответствует точке Р, в цементите -точке К диаграммы.

?
Рис.6 Кривая нагрева сплава с содержанием С = 1,2%.
Сталь в исходном состоянии имеет следующую структуру: перлит + вторичный цементит. При нагревании стали до температур ниже 723° она не будет претерпевать превращений в своем строении, т. е. указанные выше структуры сохранятся. При температуре 723° произойдет превращение перлита в аустенит. Образование аустенита сопровождается двумя процессами - перестройкой кристаллической решетки Fe в Fe и растворением цементита в образовавшемся Fe. В стали, кроме перлита, содержится цементит, то он будет растворяться в аустените при нагреве до линии ES, т. е. до критической температуры Аст. Образовавшийся аустенит не однороден по своему составу, так как процесс диффузии углерода в аустените не завершается при переходе через критические температуры А3 и Аст. Чтобы получить однородный по составу аустенит, необходимо либо повысить температуру нагрева, либо увеличить выдержку при заданной температуре. При дальнейшем нагреве стали наблюдается рост зерен аустенита. Этот процесс протекает неодинаково у различных сталей. У некоторых из них даже значительный нагрев выше критических температур не приводит к заметному росту зерен аустенита, у других же зерно аустенита заметно растет и при незначительном нагреве стали выше критических температур. При нагреве выше линии EJ до BС – часть аустените переходит в жидкое состояние получаем жидкий сплав и аустенит. Свыше линии BC – жидкий сплав.
Под числом степеней свободы системы понимают число внешних и внутренних факторов (температура, давление, концентрация), которое можно изменять без изменения числа фаз в системе. С = k-f+1 (при условии, что все превращения в металле происходят при постоянном давлении),где f- число фаз; k – число компонентов.
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или, как их называют, в разных полиморфных модификациях. В результате полиморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа. Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать α, а при более высокой – β, затем γ и т. д.
При полиморфном превращении кристаллы (зерна) новой полиморфной формы растут в результате неупорядоченных, взаимно связанных переходов атомов через границу фаз. Отрываясь от решетки исходной фазы (например, β), атомы по одиночке или группами присоединяются к решетке новой фазы (α), и, как следствие этого, граница зерна α-модификации передвигается в сторону зерна β-модификации, «поедая» исходную фазу. Зародыши новой модификации наиболее часто возникают на границах зерен исходных кристаллитов. Вновь образующиеся кристаллы закономерно ориентированы по отношению к кристаллам исходной модификации.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
Железо имеет две полиморфные модификации α и γ. Модификация α-железа существует при температурах ниже 910 °С и выше 1392 °С. В интервале температур 1392–1539 °С α-железо нередко обозначают как δ-железо.
Кристаллическая решетка α-железа – объемно центрированный куб с периодом решетки 0,28606 нм. До температуры 768 °С α-железо магнитно (ферромагнитно).
γ-железо существует при температуре 910–1392 °С; оно парамагнитно. Кристаллическая решетка γ-железа гранецентрированная кубческая (а = 0,3645 нм при 910 °С).
Как изменяются свойства деформированного металла при нагреве, какие процессы происходят при этом?
Деформированный металл по сравнению с недеформированным имеет повышенный запас энергии и находится в неравновесном, термодинамически неустойчивом состоянии. В таком металле даже при комнатной температуре могут самопроизвольно протекать процессы, приводящие его в более устойчивое состояние. Однако, если деформированный металл нагреть, то скорость этих процессов возрастает. Небольшой нагрев (для железа 300-400°С) ведет к снятию искажений кристаллической решетки, но микроструктура остается без изменений, зерна по-прежнему вытянуты. Прочность при этом несколько; снижается, а пластичность повышается. Такая обработка называется возвратом или отдыхом.
При дальнейшем повышении температуры подвижность атомов возрастает и среди вытянутых зерен идет интенсивное зарождение и рост новых равноосных свободных от напряжений зерен. Зародыши новых зерен возникают в участках с наиболее искаженной кристаллической решеткой, с повышенным уровнем свободной энергии, термодинамически наименее устойчивых. Новые зерна растут за счет старых, вытянутых, до их столкновения друг с другом и до полного исчезновения вытянутых зерен. Это явление называется рекристаллизацией (первичной).
Рекристаллизация является диффузионным процессом и протекает неравномерно, одни зерна зарождаются и растут раньше, другие позднее. После рекристаллизации металл состоит из новых равноосных зерен. Более высокий нагрев приводит к развитию собирательной рекристаллизации, т. е. к росту одних рекристаллизованных зерен за счет других, более мелких. Чем выше температура нагрева, тем интенсивнее идет собирательная рекристаллизация, так как с повышением температуры диффузионные процессы протекают быстрее и создают условия для образования крупнозернистого металла.
Вычертите диаграмму состояния железо – карбид железа, укажите структурные составляющие во всех областях диаграммы, опишите превращения и постройте кривую охлаждения (с применением правила фаз) для сплава, содержащего 0,7% С. Какова структура этого сплава при комнатной температуре и как такой сплав называется?
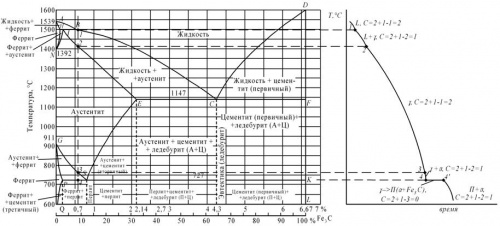
Первичная кристаллизация сплавов системы железо-углерод начинается по достижении температур, соответствующих линии ABCD (линии ликвидус), и заканчивается при температурах, образующих линию AHJECF (линию солидус).
При кристаллизации сплавов по линии АВ из жидкого раствора выделяются кристаллы твердого раствора углерода в α-железе (δ-раствор). Процесс кристаллизации сплавов с содержанием углерода до 0,1 % заканчивается по линии АН с образованием α (δ)-твердого раствора. На линии HJB протекает перитектическое превращение, в результате которого образуется твердый раствор углерода в γ-железе, т. е. аустенит. Процесс первичной кристаллизации сталей заканчивается по линии AHJE.
При температурах, соответствующих линии ВС, из жидкого раствора кристаллизуется аустенит. В сплавах, содержащих от 4,3 % до 6,67 % углерода, при температурах, соответствующих линии CD, начинают выделяться кристаллы цементита первичного. Цементит, кристаллизующийся из жидкой фазы, называется первичным. B точке С при температуре 1147°С и концентрации углерода в жидком растворе 4,3 % образуется эвтектика, которая называется ледебуритом. Эвтектическое превращение с образованием ледебурита можно записать формулой ЖР4,3Л[А2,14+Ц6,67]. Процесс первичной кристаллизации чугунов заканчивается по линии ECF образованием ледебурита.
Таким образом, структура чугунов ниже 1147°С будет: доэвтектических – аустенит+ледебурит, эвтектических – ледебурит и заэвтектических – цементит (первичный)+ледебурит.
Превращения, происходящие в твердом состоянии, называются вторичной кристаллизацией. Они связаны с переходом при охлаждении γ-железа в α-железо и распадом аустенита.
Линия GS соответствует температурам начала превращения аустенита в феррит. Ниже линии GS сплавы состоят из феррита и аустенита.
Линия ЕS показывает температуры начала выделения цементита из аустенита вследствие уменьшения растворимости углерода в аустените с понижением температуры. Цементит, выделяющийся из аустенита, называется вторичным цементитом.
В точке S при температуре 727°С и концентрации углерода в аустените 0,8 % образуется эвтектоидная смесь состоящая из феррита и цементита, которая называется перлитом. Перлит получается в результате одновременного выпадения из аустенита частиц феррита и цементита. Процесс превращения аустенита в перлит можно записать формулой А0,8П[Ф0,03+Ц6,67].
Линия PQ показывает на уменьшение растворимости углерода в феррите при охлаждении и выделении цементита, который называется третичным цементитом.
Следовательно, сплавы, содержащие менее 0,008% углерода (точкаQ), являются однофазными и имеют структуру чистого феррита, а сплавы, содержащие углерод от 0,008 до 0,03% – структуру феррит+цементит третичный и называются техническим железом.
Доэвтектоидные стали при температуре ниже 727ºС имеют структуру феррит+перлит и заэвтектоидные – перлит+цементит вторичный в виде сетки по границам зерен.
В доэвтектических чугунах в интервале температур 1147–727ºС при охлаждении из аустенита выделяется цементит вторичный, вследствие уменьшения растворимости углерода (линия ES). По достижении температуры 727ºС (линия PSK) аустенит, обедненный углеродом до 0,8% (точка S), превращаясь в перлит. Таким образом, после окончательного охлаждения структура доэвтектических чугунов состоит из перлита, цементита вторичного и ледебурита превращенного (перлит+цементит).
Структура эвтектических чугунов при температурах ниже 727ºС состоит из ледебурита превращенного. Заэвтектический чугун при температурах ниже 727ºС состоит из ледебурита превращенного и цементита первичного.
Правило фаз устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз и выражается уравнением:
C = K + 1 – Ф,
где С – число степеней свободы системы;
К – число компонентов, образующих систему;
1 – число внешних факторов (внешним фактором считаем только температуру, так как давление за исключением очень высокого мало влияет на фазовое равновесие сплавов в твердом и жидком состояниях);
Ф – число фаз, находящихся в равновесии.
Сплав железа с углеродом, содержащий 0,7 %С, называется доэвтектоидной сталью. Его структура при комнатной температуре – перлит + феррит.
Рисунок 1: а-диаграмма железо-цементит, б-кривая охлаждения для сплава, содержащего 0,7% углерода
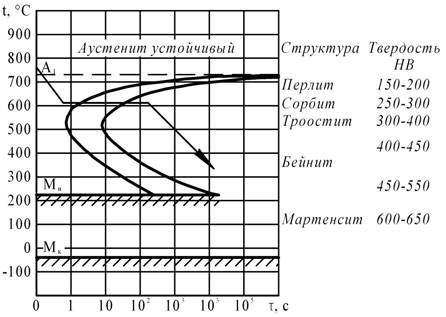
Вычертите диаграмму изотермического превращения аустенита стали У8. Нанесите на нее кривую режима изотермической обработки, обеспечивающей твердость 20. 25 HRC. Укажите, как этот режим называется и какая структура образуется в данном случае.
Диаграмма изотермического превращения аустенита стали У8
Изотермической обработкой, необходимой для получения твердости 20 – 25 HRC, является изотермический отжиг. При изотермическом отжиге сталь У8 нагревают до температуры на 30 – 50°С выше точки Ас1 и после выдержки охлаждают до температуры несколько ниже точки Аr1. При этой температуре сталь подвергают изотермической выдержке до полного превращения аустенита, затем охлаждают до комнатной температуры. Для получения структуры пластинчатого перлита заданной твердости (20 – 25HRC) устанавливается температура изотермической выдержки 640 – 660 °С.
Чем ниже температура распада аустенита, тем дисперснее продукты распада аустенита и тем выше получаемая твердость.
Изотермический отжиг по сравнению с обычным отжигом имеет два преимущества. Прежде всего, он может дать выигрыш во времени, если суммарное время ускоренного охлаждения, изотермической выдержки и последующего ускоренного охлаждения меньше времени медленного непрерывного охлаждения изделия вместе с печью. Другое преимущество изотермического отжига – получение более однородной структуры, т.к. при изотермической выдержке температура по сечению изделия выравнивается и превращение во всем объеме стали происходит при одинаковой степени переохлаждения. Структура стали У8 после изотермического отжига – перлит.
Плашки из стали У11А закалены: первая – от 760ºС, вторая – от температуры 850ºС. Используя диаграмму состояния железо-цементит, укажите температуры закалки, объясните, какая из этих плашек закалена правильно, имеет более высокие режущие свойства и почему.
Исходная структура высокоуглеродистой инструментальной стали У11А до нагрева под закалку – перлит + карбиды.
Критические точки для стали У11А: Аc1=730ºС, Аcm=810ºС.
При нагреве до 700ºС в стали У12 не происходят аллотропические превращения и мы имеем ту же структуру – перлит + карбиды, быстро охлаждая (т.к. закалка), имеем также после охлаждения перлит + карбиды с теми же механическими свойствами (примерно), что и в исходном состоянии до нагрева под закалку.
Оптимальный режим нагрева под закалку для заэвтектоидных сталей (%С>0,8%) составляет АС1+(30÷50º), т.е. для У11А – 760–780ºС. При этом после закалки имеем мелкое зерно, обеспечивающее наилучшие механические свойства стали У11А.
Нагрев и выдержка стали У11А при температуре 850ºС перед закалкой приводит к росту зерна и ухудшению механических свойств стали после термической обработки. Крупнозернистая структура вызывает повышенную хрупкость стали, иногда приводит к трещинам.
Таким образом, первая плашка закалена правильно и имеет высокие механические свойства.

Когда один элемент может существовать в виде нескольких простых веществ с разными свойствами и характеристиками, это называется аллотропией, или полиморфизмом. У металлов такая способность тоже имеется. Некоторые из них могут изменять свою структуру и качества под действием определенных факторов, что порой очень полезно в промышленности и других сферах. О том, какие металлы обладают полиморфизмом и как это проявляется, мы и расскажем.
Разные формы одного
Аллотропия – это явление, при котором один химический элемент может образовывать несколько разновидностей простых веществ. Они могут существенно отличаться друг от друга по своим физическим и химическим свойствам, но при этом состоять они будут из атомов одно и того же вида. Например, графит и алмаз совершенно не похожи: они имеют разный цвет, твердость, структуру, но оба состоят из атомов углерода.

Такие варианты называются аллотропными модификациями, а появляются они благодаря различному порядку расположения частиц в кристаллических решетках или различному строению молекул. Так, молекула из двух атомов оксигена (О2) образует простое вещество кислород, но если атомов оксигена в ней будет три (О3), то возникнет вещество озон.
Понятие «аллотропия» в научную терминологию ввел Йенс Якоб Берцелиус в 1841 году, после того как обнаружил, что винная и виноградная кислоты имеют одинаковый состав, но отличаются свойствами. Сегодня известно больше 400 модификаций, среди которых есть как неметаллы, так и металлы. Термин «аллотропия» применяют ко всем простым веществам, не привязываясь к их агрегатному состоянию. В отношении твердых веществ, причем как простых, так и сложных, употребляется термин «полиморфизм».
Явление полиморфизма металлов
Аллотропия – это распространенное явление, но характерно оно далеко не для всех элементов. Способность образовывать модификации зависит от внутреннего строения самого атома, и присуща тем элементам, которые изменяют свою валентность под действием внешних условий.
У металлов полиморфизм проявляется преимущественно под воздействием температур. Если нагреть вещество до определенного значения, ионы и атомы в его кристаллической решетке начнут перестраиваться, изменяя свое положение относительно друг друга. В итоге вещество приобретет иные свойства и перейдет в другую модификацию.

Каждая новая форма обозначается строчной буквой греческого алфавита, которая через дефис присоединяется к названию элемента. Чем ниже температура, при которой образуется модификация, тем раньше в алфавите стоит буква.
Полиморфизм металлов нашел широкое применение в промышленности. Нередко это свойство веществ используется для создания прочных сплавов. К аллотропии склоны около 30 металлов. Температурная аллотропия характерна для олова, железа, урана, бериллия, титана, кобальта. Цинк, сурьма, цезий, ртуть, галлий, литий и кадмий переходят в другие формы под действием давления.
Железо
Fe, или железо, – один из самых распространенных элементов в земной коре. В таблице Менделеева он стоит под 26-м номером. В качестве простого вещества железо является светлым пластичным металлом с сильными магнитными свойствами. Оно часто применяется в различных сферах жизни, но в большинстве случаев используется в виде сплавов с углеродом, хромом, никелем, марганцем и другими металлами.

Полиморфизм железа проявляется в четырех формах:
- Феррит (α-Fe) - до температуры в 769 °C. Обладает объемноцентрированной кубической решеткой и ферромагнетическими свойствами.
- β-Fe – выше 769 °C. Обладает ведет себя как парамагнетик и отличается от феррита только некоторыми параметрами кубической решетки. Не всегда выделяется в отдельную модификацию и рассматривается как α-Fe.
- Аустенит (γ-Fe) – выше 917 °C. Имеет гранецентрированную кубическую решетку, хуже феррита проводит ток и тепло, ведет себя как парамагнетик.
- δ-Fe – выше1394 °C. Объемноцетрированная кубическая решетка.
Олово

В периодической таблице олово, или Sn, стоит под номером 50. Это легкий, блестящий, серебристо-белый металл, который хорошо поддается плавлению и ковке. Полиморфизм металла также проявляется при разных температурных режимах:
Аллотропия – это явление, при котором один химический элемент может образовывать несколько разновидностей простых веществ. Они могут существенно отличаться друг от друга по своим физическим и химическим свойствам, но при этом состоять они будут из атомов одно и того же вида. Например, графит и алмаз совершенно не похожи: они имеют разный цвет, твердость, структуру, но оба состоят из атомов углерода.

Такие варианты называются аллотропными модификациями, а появляются они благодаря различному порядку расположения частиц в кристаллических решетках или различному строению молекул. Так, молекула из двух атомов оксигена (О2) образует простое вещество кислород, но если атомов оксигена в ней будет три (О3), то возникнет вещество озон.
Понятие «аллотропия» в научную терминологию ввел Йенс Якоб Берцелиус в 1841 году, после того как обнаружил, что винная и виноградная кислоты имеют одинаковый состав, но отличаются свойствами. Сегодня известно больше 400 модификаций, среди которых есть как неметаллы, так и металлы. Термин «аллотропия» применяют ко всем простым веществам, не привязываясь к их агрегатному состоянию. В отношении твердых веществ, причем как простых, так и сложных, употребляется термин «полиморфизм».
Явление полиморфизма металлов
Аллотропия – это распространенное явление, но характерно оно далеко не для всех элементов. Способность образовывать модификации зависит от внутреннего строения самого атома, и присуща тем элементам, которые изменяют свою валентность под действием внешних условий.
У металлов полиморфизм проявляется преимущественно под воздействием температур. Если нагреть вещество до определенного значения, ионы и атомы в его кристаллической решетке начнут перестраиваться, изменяя свое положение относительно друг друга. В итоге вещество приобретет иные свойства и перейдет в другую модификацию.

Каждая новая форма обозначается строчной буквой греческого алфавита, которая через дефис присоединяется к названию элемента. Чем ниже температура, при которой образуется модификация, тем раньше в алфавите стоит буква.
Полиморфизм металлов нашел широкое применение в промышленности. Нередко это свойство веществ используется для создания прочных сплавов. К аллотропии склоны около 30 металлов. Температурная аллотропия характерна для олова, железа, урана, бериллия, титана, кобальта. Цинк, сурьма, цезий, ртуть, галлий, литий и кадмий переходят в другие формы под действием давления.
Железо
Fe, или железо, – один из самых распространенных элементов в земной коре. В таблице Менделеева он стоит под 26-м номером. В качестве простого вещества железо является светлым пластичным металлом с сильными магнитными свойствами. Оно часто применяется в различных сферах жизни, но в большинстве случаев используется в виде сплавов с углеродом, хромом, никелем, марганцем и другими металлами.

Полиморфизм железа проявляется в четырех формах:
Олово

В периодической таблице олово, или Sn, стоит под номером 50. Это легкий, блестящий, серебристо-белый металл, который хорошо поддается плавлению и ковке. Полиморфизм металла также проявляется при разных температурных режимах:
Читайте также:

